لبنان
"نترات الأمونيوم"..المادة التي حوّلت بيروت إلى جحيم
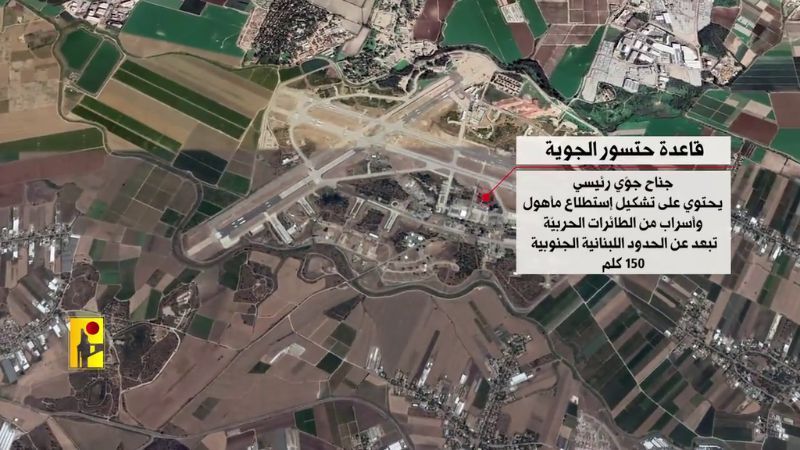
بيروت "مدينة منكوبة"، هذا ما أعلنه المجلس الأعلى للدفاع بعد انفجار شحنة "أمونيوم" تقدر بـ2750 طنا، مخزنة منذ ما يزيد عن 6 سنوات في أحد مستودعات مرفأ بيروت، فما هي "نترات الأمونيوم"؟ ولماذا تستخدم؟
"نترات الأمونيوم" (NH4NO3) هو ملح بلوري يتشكل من تفاعل مادتين -كما يشير اسمه- هما "الأمونيا" (NH3) و"حمض النيتريك" (HNO3) وهي مادة تستخدم كسماد زراعي يساهم تفككه في تزويد النباتات بالنيتروجين اللازم للنمو، وإنتاج المضادات الحيوية والخميرة، وتدخل أيضا في صناعة أعواد الثقاب والألعاب النارية، إلا أن هذه المواد قد تُستخدم كذلك لإحداث متفجرات لا يزال أبرزها تفجير مدينة أوكلاهوما عام 1995.
ونترات الأمونيوم (Ammonium nitrate) هي مادة كيميائية متاحة تجاريا بشكل مادة صلبة بلورية عديمة اللون، تستخدم في عدة أغراض، وذلك وفقا للمكتبة الوطنية للطب بالولايات المتحدة، المركز الوطني لمعلومات التكنولوجيا الحيوية.
والصيغة الجزيئية لنترات الأمونيوم هي "NH4NO3″، وهي قابلة للذوبان في الماء، ولا تحترق بسهولة، ولكنها تحترق بشكل أسهل إذا كانت ملوثة بمواد قابلة للاشتعال، وعند احتراقها، فإن مادة نترات الأمونيوم تنتج أكاسيد النيتروجين السامة.
قد تكون الغازات المنبعثة من انفجار مادة "نترات الأمونيوم" والمصبوغة باللون الأصفر خطيرة في حال تنشقها بشكل كبير، لكنها-وفق خبراء- لا يمكن عدها "غازات سامة" بأي شكل.
تتفاعل "نترات الأمونيوم" على حرارة تبلغ 200 درجة مئوية لينبعث منها "النيتروجين"، وهي غازات ملوثة تصدر عادة من عوادم السيارات والمصانع بشكل يومي، لكن ما يجعلها أكثر ضررا -كما في حالة انفجار بيروت اليوم- هو حجم الغازات المنبعث في زمن قصير، الأمر الذي قد يسبب صداعا أو ضيقا في التنفس أو وجعا في الحلق أو سعالا، إلا أن ذلك لن يؤدي إلى تشوهات خلقية أو إلى مشاكل مزمنة كما يجري الترويج بشكل خاطئ.
غاز "النيتروجين" سيتبدد مع الوقت في الهواء وسيتفاعل مع رطوبة الهواء ليتحول إلى "حمض النيتريك، الذي قد يتسبب بأضرار للمزروعات والسيارات، في ما يعرف بالمطر الحمضي.
الخصائص الفيزيائية:
اللون: من الأبيض إلى الرمادي إلى البني
عديمة الرائحة
درجة حرارة الانصهار: 169 درجة مئوية (336 درجة فهرنهايت)، وتتحلل (decomposes) عند 210 درجات مئوية (410 درجة فهرنهايت)
ووفقا لمنشور على موقع قسم علوم الغلاف الجوي والمحيطات في جامعة ميريلاند (Department of Atmospheric and Oceanic Science at the University of Maryland)، فإن نترات الأمونيوم هي مؤكسد قوي (Strong Oxidizer) وقد يتسبب اتصالها بمواد أخرى في نشوب حريق أو انفجار.
ووفقا لإدارة الصحة في نيوجيرسي (New Jersey Department of Health) فإن نترات الأمونيوم يمكن أن يتم امتصاصها عبر الجلد.
الآثار الصحية:
استنشاق نترات الأمونيوم قد يسبب تهيج الجهاز التنفسي، وقد تشمل الأعراض: السعال، التهاب الحلق، ضيق النفس، استنشاق كميات كبيرة يسبب الحماض الجهازي (systemic acidosis) ومشاكل في الهيموغلوبين.
ابتلاع نترات الأمونيوم يسبب الدوخة، آلام البطن، القيء، الإسهال الدموي، الضعف والتشنجات.
قد يسبب ابتلاع نترات الأمونيوم في حدوث ميتهيموغلوبينية الدم (methemoglobinemia)، مما يؤدي إلى زرقة (cyanosis) وهذا ينتج عن نقص الأكسجين في الدم.